Liquid Biopsy (LBx)
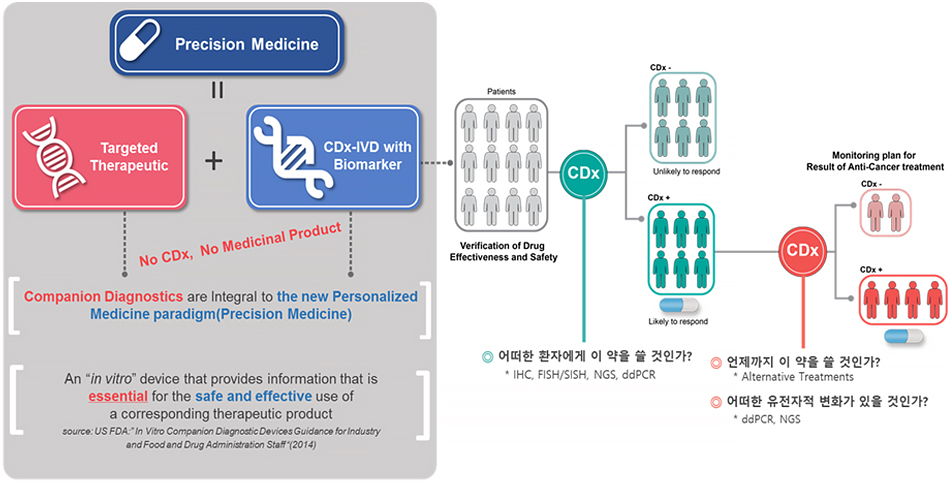
1. 동반진단의 정의 및 가치
동반진단의 주된 가치는 바로 약물에 반응하지 않을 환자에게 약물을 처방하지 않음으로써 약물의 오용으로 인한 부작용을 줄이고, 치료의 비용대비 효용성을 증가시키며, 처음부터 적합한 치료제를 선택하게 함으로써 환자에게 올바른 치료의 기회를 제공하는 데에 있다.
예를 들어, 허셉틴은 좋은 표적항암제이지만 항암치료와 허셉틴 치료를 받는 환자의 5~30%는 심장독성이라는 부작용을 경험하게 된다. 만약 허셉테스트 동반진단 검사를 통해 약물의 효과를 기대할 수 있다면 환자는 이런 부작용을 인지하고 그 위험을 감수하고라도 허셉틴 치료를 받을 것이다. 그러나 허셉틴이 환자 선별 없이 사용된다면 다수의 환자들이 효과도 없는 치료를 받으며 심장 독성으로 고통을 받게 될 것이다. 또한 현재 처방되는 표적항암제들은 일반 항암제에 비해 약 5배 이상의 약가를 가지고 있으며, 미국에서는 재정독성 (Financial Toxicity)라는 신조어가 생길 정도로 사회적인 문제를 발생시키고 있다. 이런 고가의 표적치료제들은 반드시 동반진단을 통해 해당 약물이 치료 효과를 발휘할 수 있는 환자에게 선택적으로 사용돼야 고가의 약가로 인한 환자와 보건의료재정의 부담을 덜고 표적치료제 치료의 경제적 효율성을 높일 수 있을 것이다. 또한, 환자에게 적합한 치료제를 선택할 수 있는 기회를 제공하는 가치도 결코 놓쳐서는 안 될 부분이다.
2. 동반진단 연구 및 기술 개발 현황
2-1) 국내현황
국내의 암 유전자 돌연변이 검출 키트는 대부분 유전자 증폭시약으로 MFDS (Ministry of Food and Drug Safety) IVD class 2 & 3를 승인 받았으며, 일부 제품은 신의료 기술 평가를 받아 신기술로 인정되어 심평원에서 보험수가 책정 되어 판매 및 진단에 사용 되는 제품이다.
하지만, 아직 우리나라의 경우, 의약품과 동반진단기기의 개발 및 허가가 별도로 진행되고 있어 (의약품_약사법, 동반진단기기_의료기기법), 글로벌한 시장 환경에서의 시장의 요구와 성공적인 신약 개발을 위해서 제약사와 진단키트 개발자들이 공동 개발을 계획하고 실행하는 상황으로, 이에 대한 부작용이 나타나고 있는 실정이다.
2-2) 국외현황
제약사의 신약 개발 비용 절감 및 부작용을 감소하고 삶의 질을 개선시키기 위한 표적 치료에 대한 수요가 높아짐에 따라 동반진단시장이 2013 ~ 2019년 동안 매년 18%씩 성장하고 있고, 주로 유방암, 폐암, 대장암, 위암, 흑색종 등에 관여하는 암유전자 돌연 변이 검출 키트들이 차지하고 있다. 적용되는 기술은 주로 면역조직화학검사(IHC), FISH, CISH, q-PCR 방법을 이용하고 있다. 최근에는 차세대 염기서열 분석 (Next generation sequencing, NGS) 방법을 이용한 진단 키트 또한 개발 되고 있다. 현재 시장에 85개 이상의 동반진단 테스트가 있고, 파이프라인이 만들어지면서 동반진단 테스트가 급격하게 증가하고 있다. 주로 대형 제약사가 진단회사의 기술과 노하우를 이용하여 공동으로 LBx를 개발하는 추세이다. 2019년 07월 기준으로 FDA에서 체외동반진단기기로 허가받은 제품은 총 39가지이다.
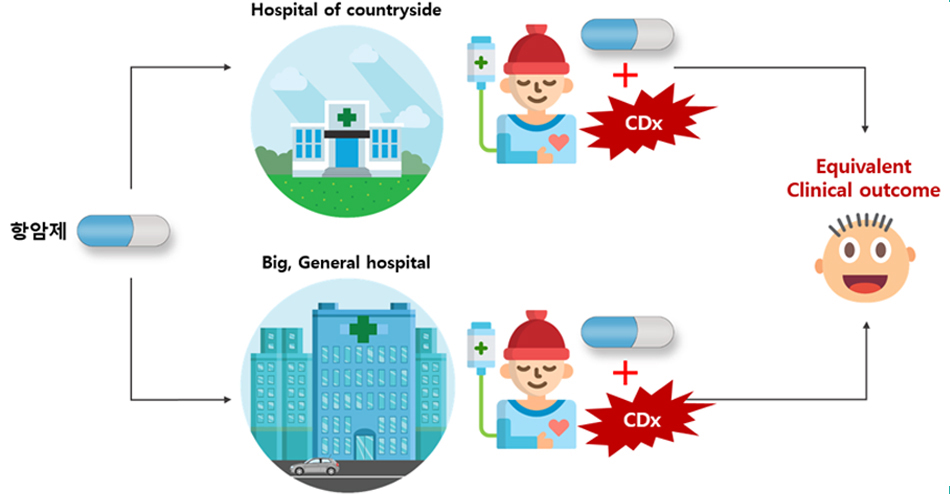
3. 동반진단의 최종 목표
세계 각지의 어떤 병원에서라도 항암제 치료 대상자를 동반진단을 통하여 선택하고, 동일한 Clinical Outcome이 도출되도록 하는 것이 동반진단의 최종 목표이다.
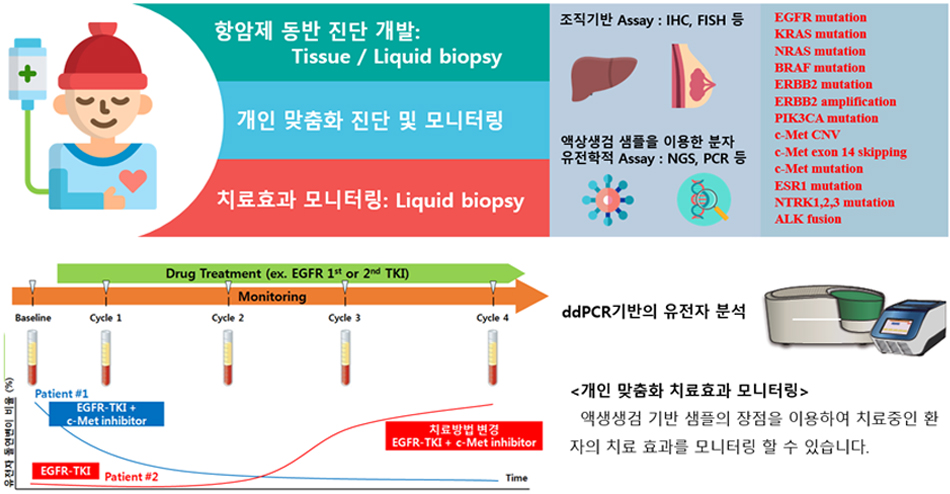
4. 현재 실험실에서 수행중인 바이오마커 탐색 연구
4-1) 항암제 동반진단 연구
암세포 특이적으로 반응하는 표적항암제는 상대적으로 부작용이 적고 치료 효과는 매우 좋다. 하지만 표적항암제는 특정 표적을 가진 암세포에만 작용하기 때문에 환자의 유전적 정보나 항암제 표적에 대한 검사를 수행하여 특정 표적 항암제에 효과를 보일 것으로 예상되는 환자를 선별하는 것이 선행되어야 한다. 동반진단은 의사의 진단에 따른 처방의 명확한 임상적 근거를 제시할 수 있으며, 환자에게는 적절한 치료법을 제시할 수 있어 암 치료 효율을 높일 수 있을 뿐만 아니라 표적항암제의 오남용을 줄여 국가의 의료 건전성 회복에도 기여할 수 있다. 본 연구실에서는 바이오마커를 선별하고 이를 진단에 활용할 수 있도록 키트 개발에 참여하고 있다.
4-2) Circulating Tumor Cell 연구 및 Single Cell Genomics
현재 글로벌 제약회사에서 환자군의 선택을 위해 사용되는 바이오마커 진단 방법으로는 IHC, FISH, CGH Array 등을 사용하는데, 이런 방법은 조직 채취 당시의 바이오마커 상태만을 반영하며, 특히 종양 이질성과 같은 특성으로 인하여 잘못된 진단이 행해질 수 있다. 또한 조직을 얻을 수 없는 환자의 진단을 수행하기에는 한계점이 있다. 이러한 단점을 극복 할 수 있는 것이 바로 액상생검 (Liquid Biopsy)이며, 환자의 혈액 샘플에서 추출한 CTC (Circulating Tumor Cells), cfDNA/RNA (Cell free DNA/RNA)를 이용하여 NGS, ddPCR 방법으로 분석하여 환자 선정 및 정확한 약물 투여 시점 및 방법까지 확인이 가능하다.
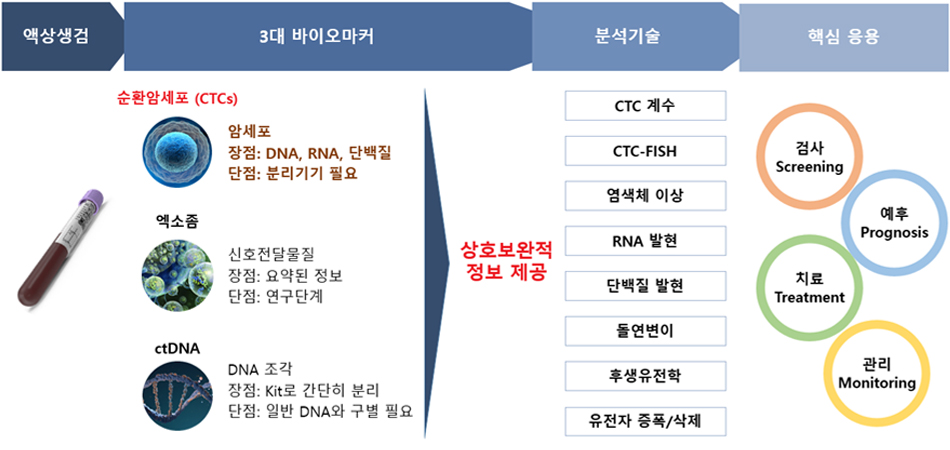
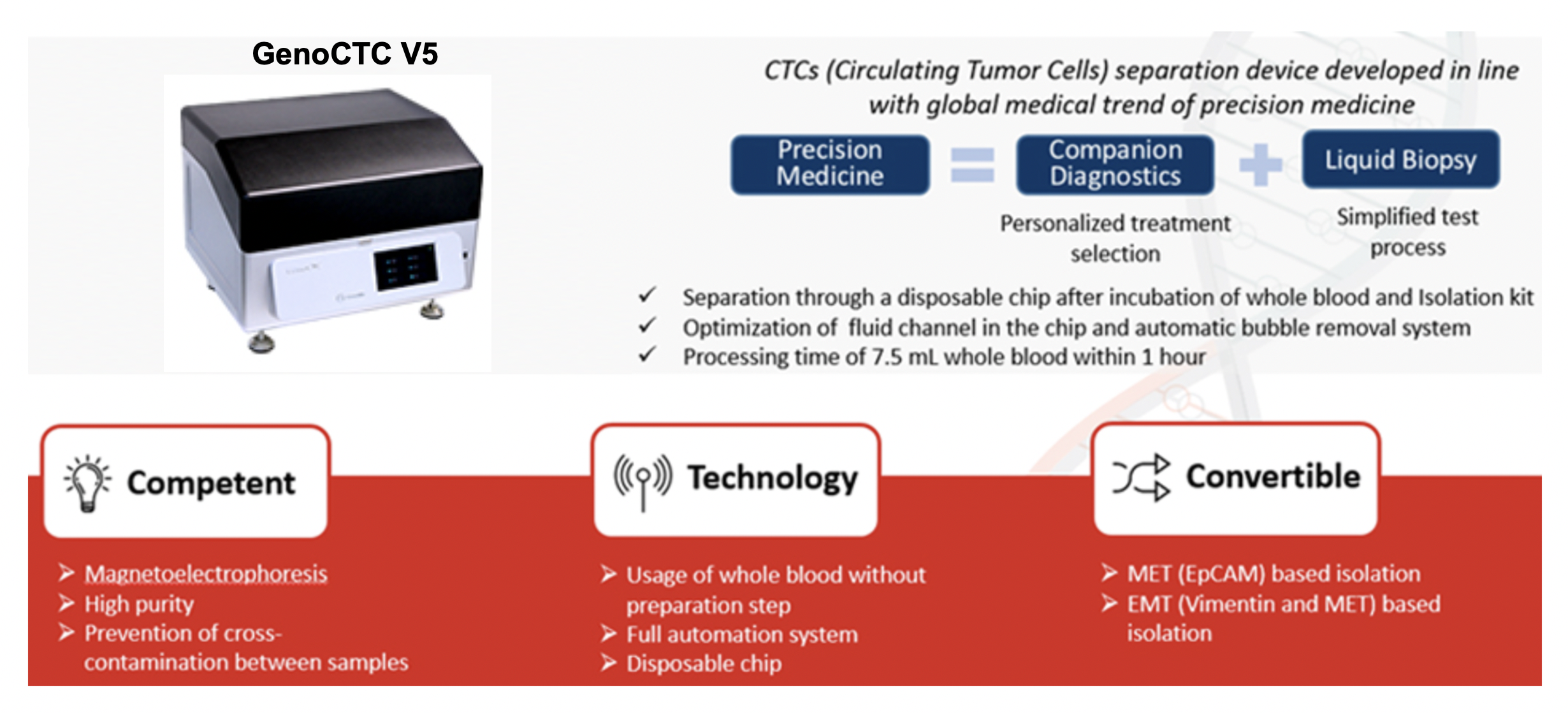
특히, CTC를 분리 할 수 있는 차세대 순환암세포 분리장비 (GenoCTC)를 도입하여 고순도의 순환 암세포를 효과적으로 분리하여 암의 특성을 연구하고, 특히 동반진단 Tool로서 적용하기 위하여 연구를 진행하고 있다.
또한 암 세포의 종양 이질성 (Tumor Heterogeneity)은 유전적으로 다양한 종양세포의 군집들이 섞여 있거나 혹은 공간적으로 분리되어 나타나게 되며, 이러한 이질성으로 인하여 각각의 종양세포 군집별로 상이한 형태의 세포증식, 대사, 면역성, 전이능을 동반하게 된다. 따라서, 종양 내 이질성은 유전적으로 다양한 세포 군집을 형성하며, 이는 항암제에 살아남을 수 있는 소수 내성 군집 세포를 제공하게 된다. 종양 내 이질성은 항암치료에 있어 내성 및 재발과 저항성 획득 기전을 이해하기 위하여 매우 활발히 연구가 진행되고 있다. 본 연구실 또한 Single cell 수준의 연구를 진행하고 있으며, 특히 GenoCTC 로 Sorting된 CTC를 면역세포 화학 염색을 통해 단백질 발현 확인 또는 WGA(Whole Genome Amplification)를 통해 유전자 변이를 확인 할 수 있도록 연구를 확장중이다.

